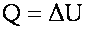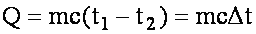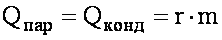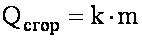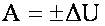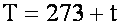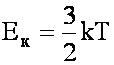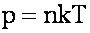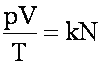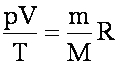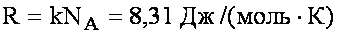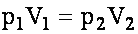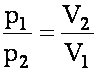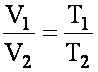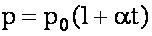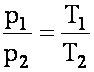Масса и размеры молекул.
Средний диаметр молекулы ≈ 3 · 10-10 м. Средний объём пространства, занимаемого молекулой ≈ 2,7 · 10-29 м3.
Средняя масса молекулы ≈ 2,4 · 10-26 кг.
Идеальный газ.
Идеальным называют газ, молекулы которого можно считать материальными точками и взаимодействие которых друг с другом осуществляется только путём столкновений.
Теплообмен.
Теплообмен - процесс обмена внутренней энергией соприкасающихся тел, имеющих разные температуры. Энергия, переданная телом или системой тел в процессе теплообмена, есть количество теплоты Q 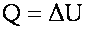
Нагревание и охлаждение.
Нагревание и охлаждение возникают благодаря получению одним телом количества теплоты Qнагр и потери другим количества теплоты Qохл. В замкнутой системе 
Количество теплоты:
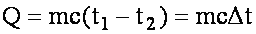
m - масса тела, Δt - измение температуры при нагревании (охлаждении), c - удельная теплоёмкость - энергия, необходимая для нагревания тела массой в 1 кг на 1° C.
Единица удельной теплоёмкости - 1 Дж/кг.
Плавление и кристаллизация

λ - удельная теплота плавления, измеряется в Дж/кг.
Парообразование и конденсация:
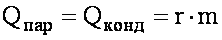
r - удельная теплота парообразования, измеряется в Дж/кг.
Сгорание
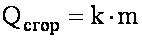
k - удельная теплота сгорания (теплоотводная способность), измеряется в Дж/кг.
Внутренняя энергия и работа.
Внутренняя энергия тела может измениться не только за счёт теплопередачи, но и за счёт совершения работы: 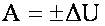
Работа, совершаемая самой системой, положительна, внешними силами - отрицательна.
Основы молекулярно-кинетической теории идеального газа
Основное уравнение молекулярно-кинетической теории идеального газа:

p - давление, n - концентрация молекул, m0 - масса молекулы.
Температура.
Температурой называется скалярная физическая величина, характеризующая интенсивность теплового движения молекул изолированной системы при тепловом равновесии и пропорциональная средней кинетической энергии поступательного движения молекул.
Температурные шкалы.
ВНИМАНИЕ!!! В молекулярной физике температура берётся в градусах по Кельвину. При любой температуре t по Цельсию, значение температуры T по Кельвину выше на 273 градуса: 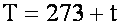
Связь температуры газа с кинетической энергией движения его молекул:
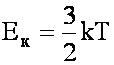
k - постоянная Больцмана; k = 1,38 · 10-23 Дж/К.
Давление газа:
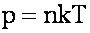
Уравнение состояния идеального газа:
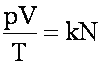
N = n · V - общее число молекул.
Уравнение Менделеева-Клайперона:
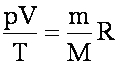
m - масса газа, M - масса 1 моля газа, R - универсальная газовая постоянная:
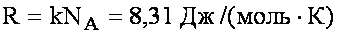
NА - постоянная Авогадро = 6,02 · 1023 моль-1 - число молекул в 1 моле вещества.
Изометрический процесс. закон Бойля-Мариотта.
При постоянной температуре T и постоянной массе m газа произведение его давления на объём есть величина постоянная: 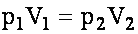
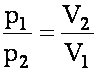
Изобарный процесс. Закон Гей-Люссака.
Объём данной массы газа при постоянном давлении зависит от температуры по линейному закону: 
V0 - исходный объём, α - изобарный коэффициент расширения, одинаковый для всех газов (α ≈1/273 К-1)
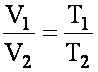
Изохорный процесс. Закон Шарля.
Давление данной массы газа при постоянном объёме зависит от температуры по линейному закону: 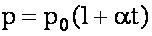
p0 - исходное давление.
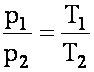
 Законы и формулы по физике и математике
Законы и формулы по физике и математике